「特管法」之於細胞療法只是前哨站,關鍵除了細胞培養技術外,首重醫療技術如何將培養完成的細胞有效植入,並產生再生醫療的效果來醫治疾病;因此,去年通過特管法後,包括基亞
(3176)、訊聯
(1784)、三顧
(3224)等,都成為市場資金追逐的標的,如今只聞樓梯響的情況改變,一旦正式提出特管法申請後,執行成效將為台灣醫療技術發展帶來不一樣的新局面。
細胞治療是全球研發主流
細胞療法是目前全球積極進行的疾病治療研發主流,包括免疫細胞療法(CAR-T)、免疫檢查點(PD-1、PL-L1)藥物等;而當中國在免疫療法上急起直追國際,全球近三分之一的CAR-T療法藥物在中國進行臨床試驗,甚至已有兩個中國本土PD-1藥物通過上市核准;日本的再生醫學則在全球大放異彩,尤其在心肌細胞重建上領先國際。那麼台灣呢?一八年九月衛福部通過特管法後,為台灣在細胞療法領域開創新局。
先從癌症病患市場看起,據分析統計,目前全球抗腫瘤市場規模約達一○○○億美元,尤其免疫療法的興起,讓預估值在二○二○年達到一五○○億美元。依據衛福部過去資料顯示,國人新發癌症人數已逾十萬人,其中癌末(四期)患者約有二萬人,依據癌末醫療費用計算,單人每年費用約五○~一○○萬元;也就是說,採用細胞治療癌末病患的市場相當於一○○~二○○億台幣規模,這是目前台灣特管法開放下的期末癌症新商機。
細胞療法如何治療癌症,是從人體中抽取血液或組織,取出所需細胞,如:T細胞、NK細胞或幹細胞等,由專業人士在GTP(人體細胞組織優良操作規範)實驗室中,經過嚴密的生技實驗流程,培養出可供患者使用的足量細胞,再注射回人體,以達到治療癌症的目的。
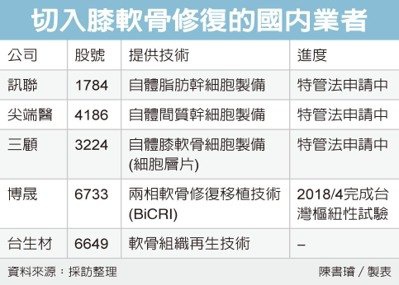
除治療癌症之外,其他包括皮膚修復(醫美)、傷口癒合、關節軟骨重生…等,都在特管法許可的六項治療領域,據特管法的規範,細胞治療技術必須由醫療院所向衛福部醫事司提出申請計畫,進行行政審查,如無疑慮,則進行下一步的專家實質審查(風管組查核生產場所,可委託合格廠商生產),查核通過後,即可按計畫施行(詳見圖表)。
而施行計畫需揭露的資訊則包括醫療場所、適應症、執業醫師、以及公開的費用等,關鍵是執行後須年年提交年度報告,依據報告內容決議該療法是否可繼續執行或終止。
目前國內包括基亞、訊聯、三顧、尖端醫(4186)、長聖(6712)、鑫品(4170)等公司,均已經擁有符合GTP規範的實驗室,也成為各大醫學中心洽談上游製造、細胞培養的合作供應商,目前已有多家醫療院所與生技公司正式提出申請(詳見圖表),當中又以引進日本再生醫學先驅CellSeed的細胞層片培養技術的三顧,由於實驗室規模已屬於細胞工廠等級,因此合作申請的醫療院所最多,其中台大醫院院長何弘能、義大醫院副院長楊智惠、北醫院場陳瑞杰都是三顧公司董事會成員。
日前三顧還與專精在顯微手術、手外科、骨科、骨腫瘤、關節重建及臂神經叢手術(擁有享譽國際的「杜氏刀法」)上都相當專精,尤其是臂神經叢重建表現非常傑出的義大醫院院長杜元坤簽約,雙方共同開發新臂神經叢重建。
特管法技術申請創新商機
長聖則有別於其他生技公司,擁有樹突腫瘤細胞疫苗製備技術、甚至在中科園區擁有最高規格的PIC/s GMP細胞製造廠,更擁有台灣唯一以異體臍帶間質幹細胞進行開發的幹細胞產品治療心肌梗塞、腦中風之一、二期臨床試驗,以及樹突細胞疫苗治療惡性腦瘤、CAR-T細胞療法研發等。
而根據特管法審查時間推估,從申請到核准最快約需時三個月;換句話說,四月國內將有正統的細胞療法開始上路。由於特管法之細胞療法是一種醫療行為,因此不需做臨床,且屬於自體免疫細胞培養再回輸體內,這與國際間研發的細胞療法是有很大的差距,不過台灣終歸已是跨出一大步,為今年有機會三讀通過的再生醫療製劑條例暖身。